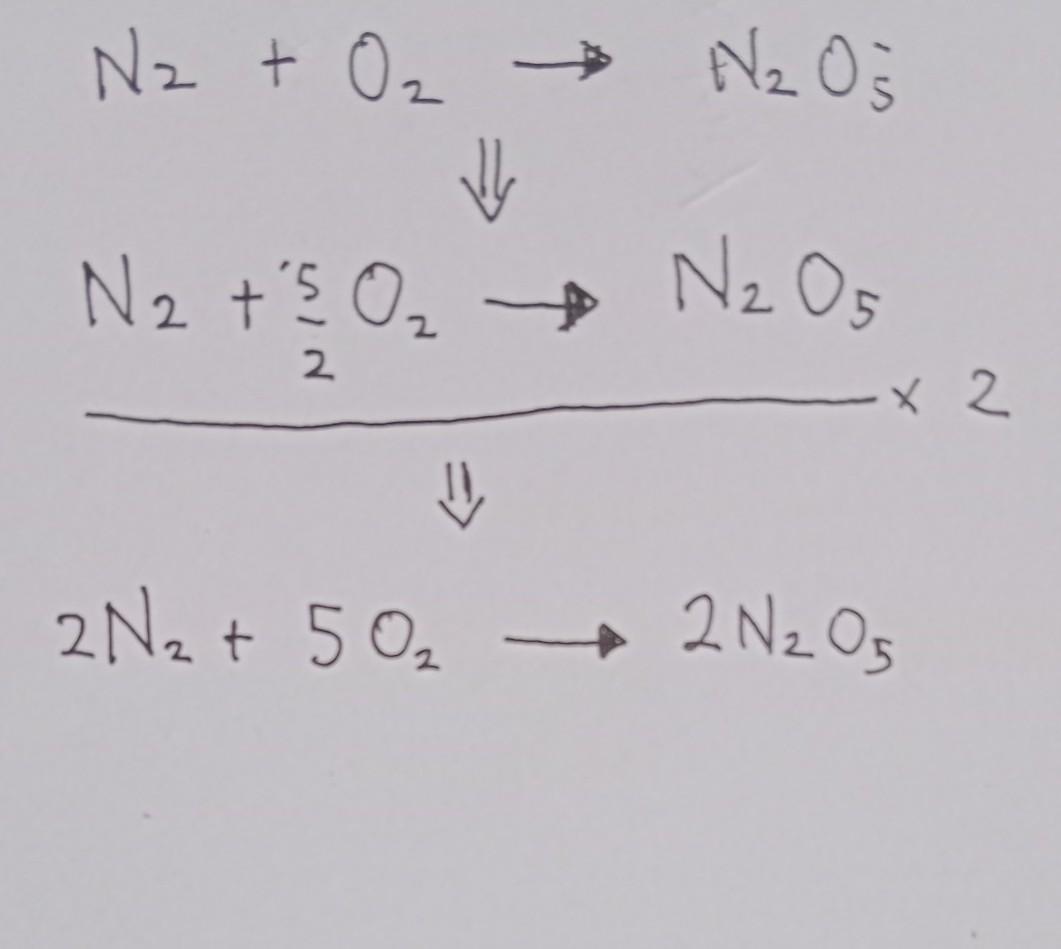
Tuliskan persamaan reaksi kimia yang telah disetimbangkan nitrogen + oksigen dinitrogen pentoksida N2 + O2 N2O5
Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
ini jawabannya sauda ada digambar semoga membantu
Pertanyaan Baru di Kimia
Mohon bantuannya buat no 9
#saintek #ujianmandiri #ipa

Kimia, Sekolah Menengah Atas
Jawaban:
B. 365 ml
Penjelasan:
Rumus pengenceran:
V1 . M1 = V2. M2
V1 . 96% = 500 . 70%
V1 = 364,58 ml dibulatkan 365 ml
Cara pembuatan logam timah hitam
Kimia, Sekolah Menengah Atas
Jawaban:
Secara pengolahan bijih timah menjadi logam timah terdiri dari operasi konsentrasi/mineral dressing, dan ekstraksi yaitu peleburan atau smelting dan pemurnian atau refining.
Timah primer= dihasilkan dari mineralisasi pada intrusi batuan granit (magmatik asam).
Tentukan ph lautan jika di ketahui konsentrasi ion h+ suatu lautan 1×10-2
Kimia, Sekolah Menengah Atas
Nilai pH larutan dengan konsentrasi ion hidrogen 10⁻² M adalah 2. Hal ini menunjukkan bahwa larutan itu bersifat asam.
Penjelasan dengan langkah-langkah
Nilai pH suatu larutan menunjukkan derajat keasaman dari larutan itu. Maka untuk mengetahui pH larutan dapat digunakan persamaan berikut:
Diketahui :
- [H⁺] = 10⁻² M
[H⁺] = 0.01 M
Ditanyakan :
- Nilai pH = ?
Penyelesaian :
Kalkulasi perhitungan pH
- pH = – log (0.01)
pH = 2
Pelajari lebih lanjut
- Materi tentang perhitungan pH larutan garam bersifat basa
- Materi tentang perhitungan ph larutan asam lemah
- Materi tentang perhitungan derajat ionisasi
______________
Detail jawaban
Mapel : Kimia
Kelas : XI
Bab : Stoikiometri larutan
Kode : 11.7.6
Tulis senyawa yang bertindak sebagai reaktan dan produk dari reaksi : Al2O3(s) + HCl(aq) → AlCl3(aq) + H2O(l)
Kimia, Sekolah Menengah Atas
Jawaban:
Reaktan adalah zat zat yg berada di ruas kiri yaitu
Al2O3 & HCl
Jika penentuan pH asam kuat dipengaruhi oleh [H^+ ] dan ⌈H^+ ⌉=valensi x M. Dan harga untuk log 10 = 1, harga untuk log 4=0,3. Maka harga pH dari H2SO4 0,02 M adalah.
Kimia, Sekolah Menengah Atas
Jawaban:
1,7
Penjelasan:
H2SO4 => 2 H^+ + SO4^2- maka valensi asam ( jumlah ion H+ ) = 2
[H+] = 2 x 2 x 10^-2 M ( 0,02 M = 2 x 10^-2 M ) [H+] = 4 x 10^-2 MpH = – log [H+]
pH = – log ( 4 x 10^-2 M )
pH = 2 – log 4 atau 2 – 0,3 = 1,7
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

