Perbandingan massa besi dan massa oksigen pada senyawa besi (II) oksida adalah 7 : 2. Jika gas oksigen yang diperlukan adalah 14 gram. Maka massa besi yang bereaksi adalah …. Pilih salah satu:
a. 14 gram
b. 49 gram
c. 2 gram
d. 7 gram
e. 42 gram
Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
E.
Penjelasan:
Dengan perbandingan masaa Fe : O = 7 : 2 dan massa Oksigen yg diketahui adalah 14 gram, maka massa besi yg bereaksi = ( 7 / 2 ) x 14 gram = 49 gram
Pertanyaan Baru di Kimia
Lihat soal digambar dan wajib pakai cara!!!

Kimia, Sekolah Menengah Atas
Jawaban:
D. 7 : 4
Penjelasan:
massa Fe : massa S = ( mol Fe x Ar Fe ) : ( mol S x Ar S ) , mol Fe & mol S dapat dilihat dari perbandingan koefisien dalam reaksi
massa Fe : massa S = ( 1 x 56 ) : ( 1 x 32 )
massa Fe : massa S = 56 : 32 = 7 : 4
Kesimpulan sistem pariodik modern,sejarah perkembangan sistem unsur pariodik dan sifat pariodik unsur ? kesimpulan nya dari semua materi tersebut!!! tolong yaa
Kimia, Sekolah Menengah Atas
Jawaban:
Di tahun 1984, J.A.R Newlands mengklasifikan unsur berdasar kenaikan berat atomnya. Unsur ini dapat dikenali dengan nomor urut dan dibagi dalam tujuh golongan.
Ketujuh golongan tersebut ialah Hidrogen, Litium, Berilium, Karbon, Nitrogen, Boron serta Oksigen. Hubungan ketujuh golongan ini dikenal sebagai hokum oktaf.
Golongan pada sistem periodik unsur itu sendiri merupakan kolom vertikal yang terdapat pada tabel periodik. Golongan dianggap penting untuk metode pengklasifikasian unsur-unsur.
Pengelompokan dalam golongan ini ialah unsur-unsur yang memiliki susunan elektron terluar yang sama. Karena memiliki elektron yang sama, maka unsur-unsur tersebut memiliki sifat kimia yang sama.
Unsur-unsur pada golongan pertama merupakan logam alkali atau golongan utama. Sedangkan golongan kedua dinamakan logam transisi merupakan logam alkali tanah. Dan dua deret dari bagian bawah merupakan logam transisi dalam yang terdiri atas lanthanide dan aktinida.
Sedangkan periode ialah barisan horizontal yang terdapat pada tabel periodik. Terdapat 7 periode dalam tabel periodik, di mana masing-masing tabel mewakili tingkat energi atom yang dimiliki.
Tidak semua periode memiliki jumlah unsur yang sama. Di mana jumlah unsur terkecil terdapat pada periode 1 yang berjumlah 2 unsur. Sedangkan jumlah unsur tebanyak ialah pada periode 6 yang memiliki 32 unsur.
Sifat-sifat pada Sistem Periodik Unsur
Dalam sistem periodik unsur, terdapat beberapa sifat, di antaranya ialah sifat logam, jari-jari atom dan juga energi ionisasi. Dan berikut pemahaman mengenai sifat sistem periodik unsur yang telah dirangkum dari berbagai sumber.
1. Sifat Unsur
Berdasarkan sifat unsur-unsur bisa dibagi ke dalam 3 jenis, yaitu logam, non logam dan juga metalloid. Pada logam memiliki sifat yang cenderung melepaskan elektron dari non logam untuk membentuk ion positif.
Sedangkan untuk non logam, mereka cenderung menerima elektron dari logam. Lain halnya dengan unsur-unsur metalloid dimana unsur metalloid memiliki kedua sifat seperti logam dan non logam.
2. Jari-jari Atom
Jari-jari atom ialah jarak dari inti atom ke orbital elektron terluar yang stabil dalam suatu atom dalam keadaan setimbang. Jarak tersebut dapat diukur dalam satuan pikometer atau angstrom.
Dalam satu golongan dari atas ke bawah, jari-jari atom cenderung untuk membesar setara dengan pertambahan dapa kulit elektron.
3. Energi Ionisasi
Energi ionisasi pertama ialah energi yang diserap untuk melepas satu elektron dari sebuah atom. Sedangkan energi ionisasi atom kedua ialah energi yang diserap untuk meleas elektron kedua dari sebuah atom, dan seterusnya.
4. Afinitas Elektron
Afinitas eletron ialah jumlah energi yang dilepaskan ketika sebuah elektron ditambahkan ke dalam kolom atom netral untuk membentuk ion negative. Sifat non logam memiliki nilai lebih tinggi pada afinitas elektron daripada sifat logam. Dan afinitas elektron secara umum terus meningkat sepanjang periode.
5. Kelektronegatifan
Kelektronegatifan merupakan kemampuan atau kecenderungan suatu atom untuk menangkap ataupun menarik kembali elektron dari atom lainnya.
1. Robert Boyle
Pada sejarah perkembangannya sistem periodik unsur yang dipakai pada saat ini merupakan sistem periodik unsur modern yang dipublikasikan oleh Dimitri Mendeleev pada tahun 1869.
Sedangkan menurut sejarahnya Robert Boyle merupakan orang pertama yang memberikan definisi mengenai unsur. Menurutnya unsur merupakan zat yang tidak dapat dibagi menjadi dua zat atau lebih secara kimiawi.
2. Lavoiser
Setelah Boyle memberikan penjelasan mengenai hal tersebut, pada tahun 1769 Lavoiser pun menerbitkan daftar unsur-unsur dan membaginya pada unsur logam maupun unsur non logam.
Dan menurut Lavoiser terdapat perbedaan antara logam dan non logam di antaranya,
Logam:
-Berwujud padat pada suhu kamar kecuali raksa
-Mengkilap saat di gosok-gosokan
-Merupakan konduktor yang baik
-Dapat ditempa atau direnggangkan
-Penghantar panas yang baik
Non logam:
-Ada yang berupa zat padat, cair atau gas pada suhu kamar
-Tidak mengkilap jika digosok, keculai intan atau karbon
-Bukan konduktor yang baik
-Umumnya rapuh terutama berwujud padat
-Bukan penghantar panas yang baik.
3. Johann Wolfgang Dobereiner
Dobereiner merupakan orang pertama yang menemukan hubungan sifat dengan massa atom.unsur-unsur tersebut dikelompokkan menjadi 3 triade, yaitu
Triade Litium (Li), Natrium (Na), Kalium (K)
Triade Kalsium (Ca), Stronsium (Sr), Barium (Br)
Triade klor (Cl), Brom (Br), Iodium (I)
4. Dmitri Mendeleev
Pada tahun 1869 Dmitri Ivanovich Mendeleev melakukan pengamatan 63 unsur yang telah dikenal dan mendapatkan hasil bahwa sifat dari massa atom itu relatif. Berdasarkan hasil pengamatannya ia menempatkan unsur-unsur tersebut pada golongan dan juga periode yang dikenal saat ini.
mohon bantuannya teman teman, disertakan dengan penjelasan nya ya. tolong jangan bercanda.. terimakasih banyak

Kimia, Sekolah Menengah Pertama
Jawaban:
Zat P = KBr
Zat Q = HCl
Zat R = Asam Cuka (CH₃COOH)
Zat S = Gula
Penjelasan:
- Pada Zat P itu KBr dimana itu merupakan campuran garam yang memilki sifat kuat yakni Logam KOH dan larutan HBr yang tentunya campuran larutan tersebut sifat elektrolitnya sangat kuat ketika di uji larutan tersebut elektroda tersebut memiliki banyak gelembung dan lampu tersebut menyala
- Pada Zat Q itu HCl dimana itu adalah asam kuat yang sifat larutannnya itu elekrolit kuat sehingga ketika di uji larutan memilki banyak gelembung dan lampu nya menyala
- Pada zat R itu Asam Cuka dimana itu adalah asam lemah yang memilki sifat larutan elektrolit lemah sehingga ketika di uji larutan tersebut memiliki sedikit gelembung dan lampunya tidak menyala
- Pada zat S itu Gula dimana larutan gula itu sifatnta laritannya non elektrolit sehingga ketika di uji larutan tersebut tidak memilki gelembung dan lampu tidak menyala
Pada saat besi dipanaskan didalam gas klor akan dihasilkan senyawa besi klorida yang mengandung 34,5% massa besi. A. Tentukan rumus empiris senyawa besi kloridab. Jika Mr senyawa = 325, bagaimana rumus molekul senyawanya .
Kimia, Sekolah Menengah Atas
Jawaban:
Rumus empiris: FeCl3
Rumus molekul: Fe2Cl6
Penjelasan:
Misal senyawa besi klorida = 100 gram
massa besi = 34,5% x 100 gram = 34,5 gram
massa klorida = 65,5℅ x 100 gram = 65,5 gram
Mencari perbandingan mol besi dengan klorida dengan rumus : mol = massa / Ar
Ar besi = 56 , Ar Cl = 35,5
mol besi = 34,5 / 56 = 0,62 mol
mol klorida = 65,5 / 35,5 = 1,84 mol
mol besi : mol klorida = 0,62 : 1,84 mol = 1 : 3
Jadi rumus empiris besi klorida: FeCl3
( FeCl3 ) n = Mr
( 1 x Ar Fe + 3 x Ar Cl ) n = 325
( 1 x 56 + 3 x 35,5 ) n = 325
( 111,5 ) n = 325
n = 2
( FeCl3 ) 2 => Fe2Cl6
Hitunglah perubahan enthalpy standar ΔH0 pada suhu 250 untuk reaksi berikut : N2H4 (l) + O2 (g) ⇔ NO2 (g) + H2O (l)
Dengan menggunakan enthalpy standar pembentukan (ΔHf0) rekatan dan produk pada suhu 250C
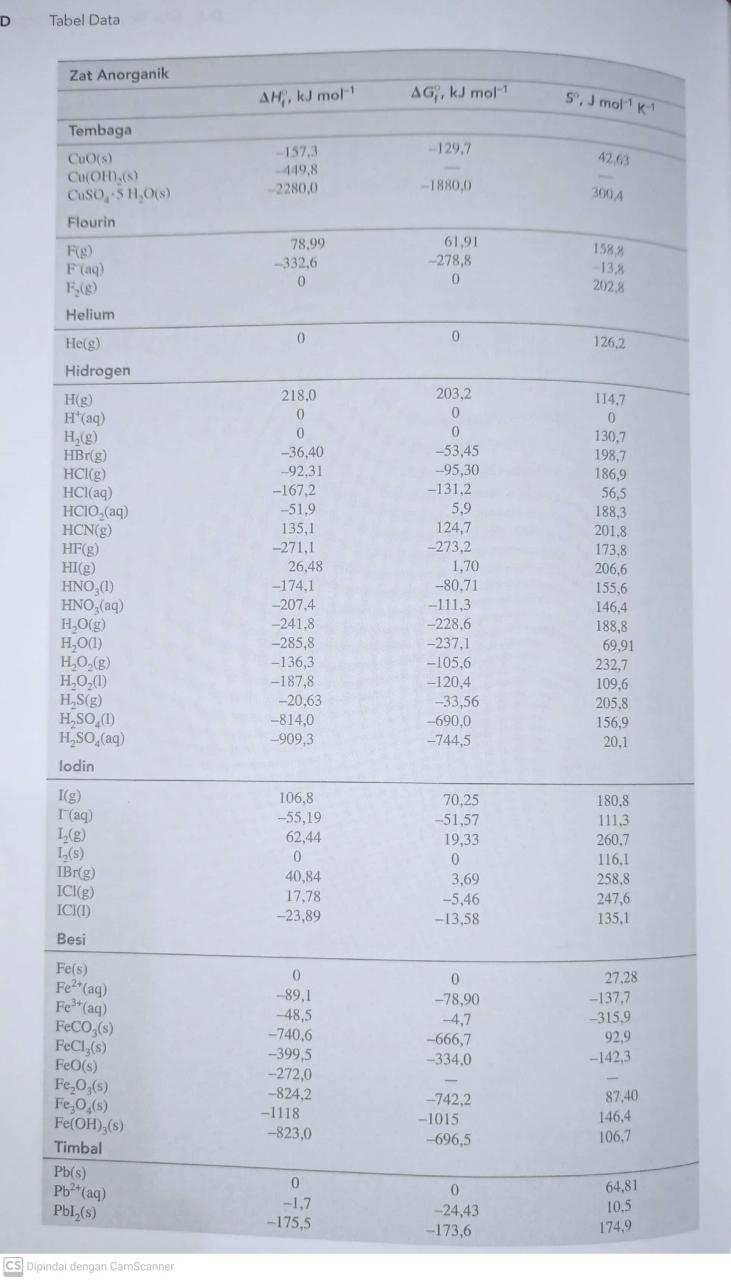
Kimia, Sekolah Menengah Atas
Jawaban:
N₂H₄ + 3O₂ ⇔ 2NO₂ + 2H₂O ( Sudah Setara)
ΔH = ΔHf produk – ΔHf reaktan
ΔH = (2 × ΔHf NO₂ + 2 ΔHf × H₂O) – ( 1 × ΔHf N₂H₄ + 3 × ΔHf O₂ )
ΔH = ( 2 × 33,18 + 2 × (-285,8)) – ( 1 × 50,63 + 3 × 0)
ΔH = (66,36 + (-571,6)) – 50,63
ΔH = -505,24-50,63
ΔH = -555,87
Penjelasan:
Semoga Bermanfaat makasih, jangan lupa dijadikan jawaban tercerdas ya :v
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

