Jika penentuan pH asam kuat dipengaruhi oleh [H^+ ] dan ⌈H^+ ⌉=valensi x M. Dan harga untuk log 10 = 1, harga untuk log 4=0,3. Maka harga pH dari H2SO4 0,02 M adalah.
Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
1,7
Penjelasan:
H2SO4 => 2 H^+ + SO4^2- maka valensi asam ( jumlah ion H+ ) = 2
[H+] = 2 x 2 x 10^-2 M ( 0,02 M = 2 x 10^-2 M ) [H+] = 4 x 10^-2 MpH = – log [H+]
pH = – log ( 4 x 10^-2 M )
pH = 2 – log 4 atau 2 – 0,3 = 1,7
Pertanyaan Baru di Kimia
Sebanyak 50 ml larutan CH3COOH 0,2 m (ka=10⁵) dicampurkan dengan 50 ml larutan NaOH 0.1 m. Hilunglah pH larutan tersbt
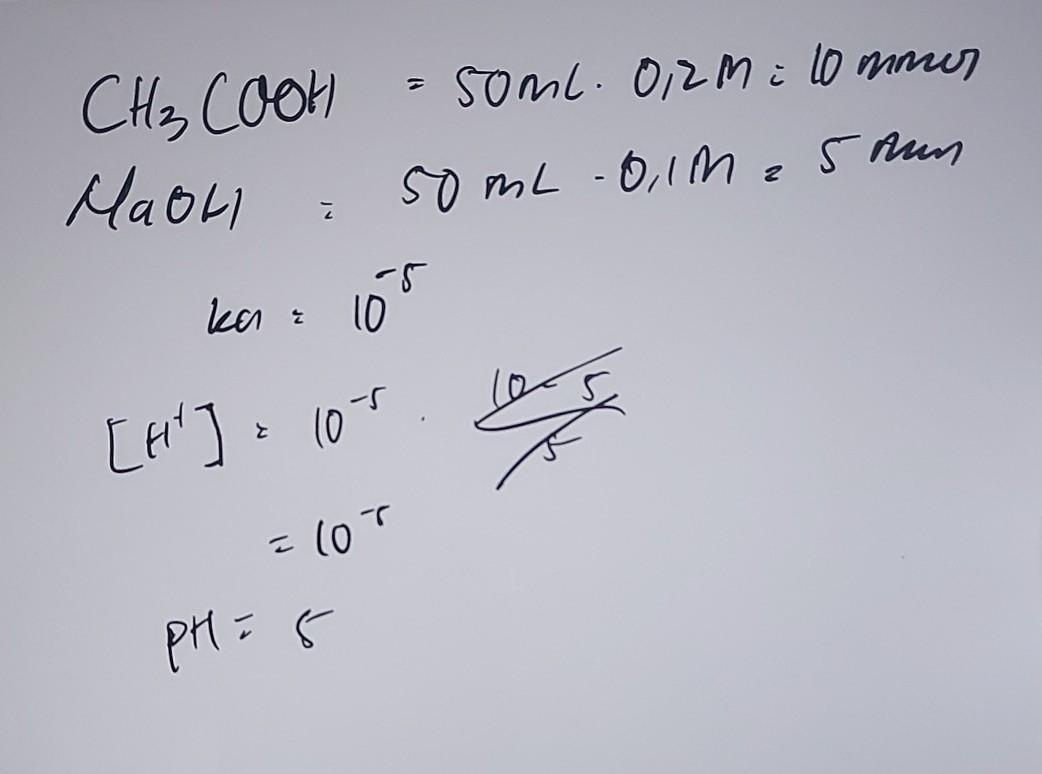
Kimia, Sekolah Menengah Atas
jawabannya ada pada gambar di atas
Kristal karbon terdapat dalam bentuk grafit dan intan. A.Disebut apakah perbedaan bentuk pada unsur yang sama?
B.Apakah kegunaan intan? Jelaskan
Jawab A dan B
Kimia, Sekolah Menengah Atas
Jawaban:
A. Alotrop
B. Perhiasan, sebagai bahan khusus untuk alat memotong kaca
Penjelasan:
karbon dan intan sama2 tersusun atas atom karbon, namun perbedaannya terdapat pada bentuk strukturnya. intan memiliki struktur yang teratur(kristal) sedangkan grafit memiliki struktur tidak teratur(amorf)
Tolong, kimia kelas 11 materi hidrokarbon
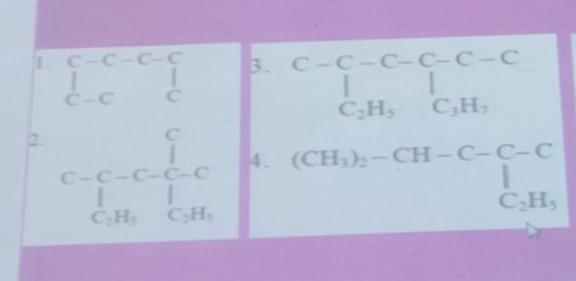
Kimia, Sekolah Menengah Atas
Penjelasan:
a. Heptana
b. 3,3,6-trimetil heptana
c. 4-etil-6-metil oktana
d. 2,4-dimetil heksana
cara kerja : tentukan rantai terpanjang, berikan nomor mulai dari cabang paling dekat, berikan nama terhadap setiap cabang, susun seperti diatas
kalo benar kasih jawaban terbaik, kalo salah komen:)
Berapa mg H2c2o4 yang ekivalen dengan 20 ml 0,1 N naoh
Kimia, Sekolah Menengah Pertama
1. tentukan ekivalen dari NaOH
N = eq/volume (L)
eq = N . Vol
= 0,1 . 0,02
= 0,002 eq
2. tentukan massa dari H2C2O4
(valensi = 2 karena asam oksalat memiliki 2 H+)
eq = mol x Valensi
mol = eq/ valensi
= 0,002/2
= 0,001 mol
mol = gr/Mr
gr = mol . Mr
gr = 0,001 . 90
gr = 0,09 gram = 90 mg
kalau benar kasih jawaban terbaik, kalo salah komen 🙂
Perhatikan data energi ionisasi berikut! Unsur Energi Ionisasi ke- 1 2 3 4 5 6 X 1.400 2.860 4.580 7.500 9.400 53.000 Y 738 1.450 7.730 10.500 13.600 18.000 Apabila unsur X dapat berikatan dengan unsur Y, maka senyawa yang terbentuk adalah
Kimia, Sekolah Menengah Atas
Jawaban:
X2Y3 (ion)
Penjelasan:
berdasarkan data ionisasi di atas, dapat disimpulkan bahwa X berada di gol. 5 sedangkan Y berada di golongan 2. dengan begitu, senya yang akan terbentuk adalah senyawa dengan rumus molekul X2Y3. ikatan yang terjadi adalah ikatan ion
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

