Berapa bilangan oksidasi nitrogen dan senyawa (NH4)2CO3?
Mapel Kimia, Jenjang Sekolah Menengah Atas
Bilangan oksidasi (biloks) dari nitrogen dalam senyawa (NH₄)₂CO₃ adalah –3. Adapun biloks unsur C, O, dan H berturut-turut adlaah +4, -2, dan +1.
Penjelasan dengan langkah-langkah
Biloks atau bilangan oksidasi adalah suatu bilangan atau angka yang dimiliki oleh suatu unsur dalam suatu senyawa atau molekul dan menunjukkan muatan unsur itu. Berikut beberapa nilai biloks unsur/molekul :
- Biloks C umumnya +4 mengingat unsur C terletah pada golongan IVA yang cenderung melepas elektron untuk memenuhi kaidah oktet.
- Biloks O = -2, kecuali pada senyawa superoksida dan peroksida.
- Biloks H = +1, kecuali pada senyawa hidrida.
- Biloks molekul = 0
Diketahui :
- Rumus molekul:
(NH₄)₂CO₃ - Biloks O = -2
- Biloks H = +1
- Biloks C = +4
Ditanyakan :
- Biloks N = ?
Penyelesaian :
Perhitungan biloks N
- Biloks (NH₄)₂CO₃ =
2 x (Biloks N + 4 x Biloks H) + Biloks C + 3 x Biloks O
Biloks (NH₄)₂CO₃ = 2 x (Biloks N + 4(+1)) + (+4) + 3 x (-2)
Biloks (NH₄)₂CO₃ = 2 Biloks N + 8 + 4 -6
Biloks (NH₄)₂CO₃ = 2 Biloks N + 6
Karena (NH₄)₂CO₃ merupakan molekul tak bermuatan, maka
- 0 = 2 Biloks N + 6
Biloks N = -6/2 = -3
Kesimpulan
Biloks N dalam (NH₄)₂CO₃ adalah -3.
Pelajari lebih lanjut
- Materi tentang perhitungan biloks Mn:
- Materi tentang contoh soal dan pembahasan terkait biloks:
- Materi tentang redoks dan autoredoks:
______________
Detail jawaban
Mapel : Kimia
Kelas : 10
Bab : Redoks
Kode : 10.7.9
#SolusiBrainlyCommunity
Pertanyaan Baru di Kimia
Tuliskan persamaan reaksi kimia yang telah disetimbangkan nitrogen + oksigen dinitrogen pentoksida N2 + O2 N2O5
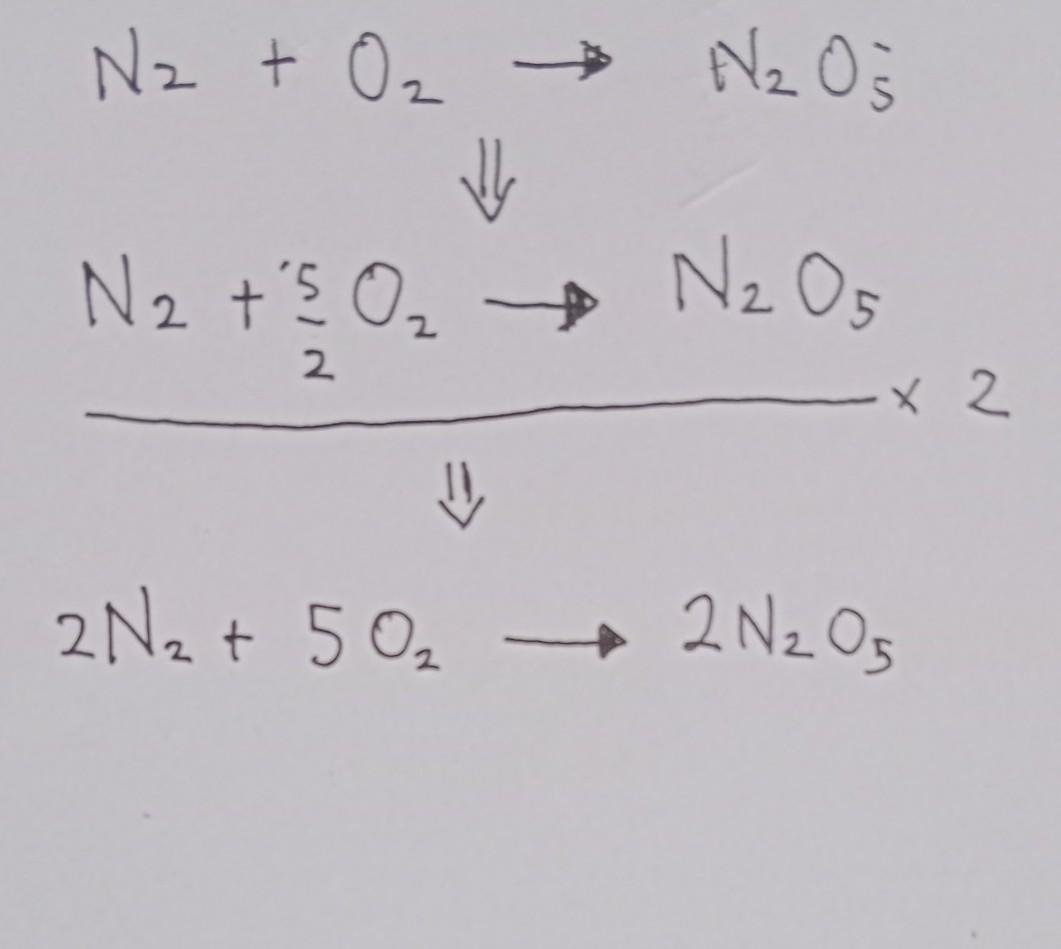
Kimia, Sekolah Menengah Atas
Jawaban:
ini jawabannya sauda ada digambar semoga membantu
2. Selesaikan persamaan reaksi redoks berikut, manakah senyawa yang bertindak Oksidator dan reduktor pada reaksi berikut: (HOTS) MnO2+4HC1→ MnCl2 + 2H2O + Cl2

Kimia, Sekolah Menengah Atas
Jawaban:
oksidator : MnO2
Reduktor : HCl
Penjelasan:
MnO2+4HC1→ MnCl2 + 2H2O + Cl2
+4 -1 +2 0
HCl → Cl2 dimana terjadi kenaikan bilangan oksidasi (reduktor) dimana bilangan oksdasinya awalnya -1 menjadi 0
MnO2 → MnCl2, dimana terjadi penurunan bilangan oksidasi (oksidator) dimana bilangan oksidasi nya awalnya + 4 menjadi +2
Dari senyawa-senyawa berikut yang massa molekul relatifnya (mr) paling besar adalah….( ar h = 1, n = 14, c = 12, o = 16, s = 32)
Kimia, Sekolah Menengah Atas
Jawaban:
soalnya kurang lengkap
Penjelasan:
tidak jelas soalnya
Bantu jawab kimia dengan caranya
Terima kasih

Kimia, Sekolah Menengah Atas
Jawaban:
jawabannya ada di gambar semoga membantu ya
Berapa bilangan oksidasi nitrogen dan senyawa (NH4)2CO3?
Kimia, Sekolah Menengah Atas
Bilangan oksidasi (biloks) dari nitrogen dalam senyawa (NH₄)₂CO₃ adalah –3. Adapun biloks unsur C, O, dan H berturut-turut adlaah +4, -2, dan +1.
Penjelasan dengan langkah-langkah
Biloks atau bilangan oksidasi adalah suatu bilangan atau angka yang dimiliki oleh suatu unsur dalam suatu senyawa atau molekul dan menunjukkan muatan unsur itu. Berikut beberapa nilai biloks unsur/molekul :
- Biloks C umumnya +4 mengingat unsur C terletah pada golongan IVA yang cenderung melepas elektron untuk memenuhi kaidah oktet.
- Biloks O = -2, kecuali pada senyawa superoksida dan peroksida.
- Biloks H = +1, kecuali pada senyawa hidrida.
- Biloks molekul = 0
Diketahui :
- Rumus molekul:
(NH₄)₂CO₃ - Biloks O = -2
- Biloks H = +1
- Biloks C = +4
Ditanyakan :
- Biloks N = ?
Penyelesaian :
Perhitungan biloks N
- Biloks (NH₄)₂CO₃ =
2 x (Biloks N + 4 x Biloks H) + Biloks C + 3 x Biloks O
Biloks (NH₄)₂CO₃ = 2 x (Biloks N + 4(+1)) + (+4) + 3 x (-2)
Biloks (NH₄)₂CO₃ = 2 Biloks N + 8 + 4 -6
Biloks (NH₄)₂CO₃ = 2 Biloks N + 6
Karena (NH₄)₂CO₃ merupakan molekul tak bermuatan, maka
- 0 = 2 Biloks N + 6
Biloks N = -6/2 = -3
Kesimpulan
Biloks N dalam (NH₄)₂CO₃ adalah -3.
Pelajari lebih lanjut
- Materi tentang perhitungan biloks Mn:
- Materi tentang contoh soal dan pembahasan terkait biloks:
- Materi tentang redoks dan autoredoks:
______________
Detail jawaban
Mapel : Kimia
Kelas : 10
Bab : Redoks
Kode : 10.7.9
#SolusiBrainlyCommunity
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

