pupuk NPK yang beratnya 760 kg dengan perbandingan presentase N:P:K=18:5:15 memerlukan kalium sebanyak…
Mapel Kimia, Jenjang Sekolah Menengah Atas
Pupuk NPK yang beratnya 760 kg dengan perbandingan persentase N : P : K = 18 : 5 : 15 memerlukan kalium sebanyak 114 kg.
Pembahasan
Pupuk adalah salah satu bahan tambahan yang digunakan untuk memenuhi unsur hara dalam tanah bagi tanaman. Pupuk NPK termasuk jenis pupuk yang memiliki kadar unsur hara nitrogen (N), fosfor (P), dan kalium (K) yang cukup tinggi. Berbeda dengan pupuk urea yang hanya mengutamakan kadar nitrogen dalam pupuknya. Bahan untuk pembuatan NPK bisa dari beberapa bahan berikut :
- Unsur N dari pupuk urea
- Unsur K dari KCl
- Unsur P dari pupuk ZA
- Binding agent (zat yang dapat menyatukan bahan-bahan utama pupuk menjadi suatu bentuk tertentu seperti granul)
- Pewarna (kadang ada/tidak)
Diketahui :
- Massa pupuk NPK
m NPK = 760 kg - Komposisi NPK
N = 18%
P = 5%
K = 15%
sedangkan sisanya adalah bahan tambahan. - Mr KCl = 74.5 g/mol
Ar K = 39 g/mol
Referensi :
Ditanyakan :
- Kalium dalam pupuk = ?
Penyelesaian :
Perhitungan kalium dalam pupuk
m K = 15% x m NPK
m K = 15% x 760 kg
m K = 114 kg
Kalau kaliumnya dari KCl
Perhitungan massa KCl
m KCl = Mr KCl : Ar K x m K
m KCl = (74.5) : 39 x 114
m KCl = 218 kg
Kesimpulan
Kalium yang diperlukan adalah 114 kg.
Massa KCl yang diperlukan adalah 218 kg.
Pelajari lebih lanjut
- Materi tentang pupuk urea:
- Materi tentang pupuk NPK, TSP, dan urea:
- Materi tentang pembuatan pupuk ZA:
______________
Detail jawaban
Mapel : Kimia
Kelas : X
Bab : Stoikiometri
Kode : 10.7.6
#SolusiBrainlyCommunity
Pertanyaan Baru di Kimia
Pasangan senyawa berikut yang dalam larutannya menghasilkan ion OH- adalah…. A. HNO3 dan CH3COOH
B. Ca(OH)2 dan Mg(OH)2
C. CH3COOH dan Mg(OH)2
D. Ca(OH)2 dan CHOOH
E. CH3COOH dan NaOH
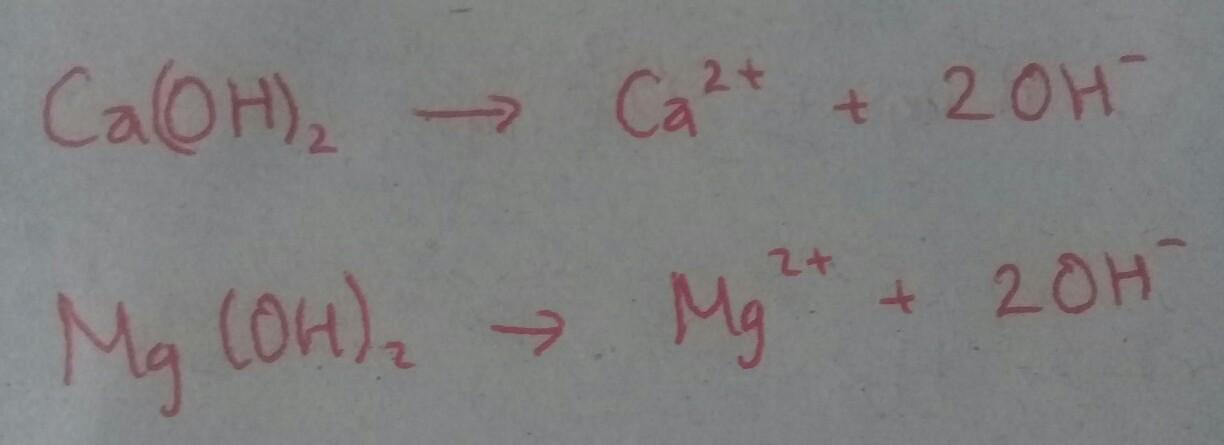
Kimia, Sekolah Menengah Atas
Jawaban:
B. Ca(OH)2 dan Mg(OH)2
Penjelasan:
Cek di foto ya
Gambarkan struktur dari senyawa
trans-1-klorobut-2-ena
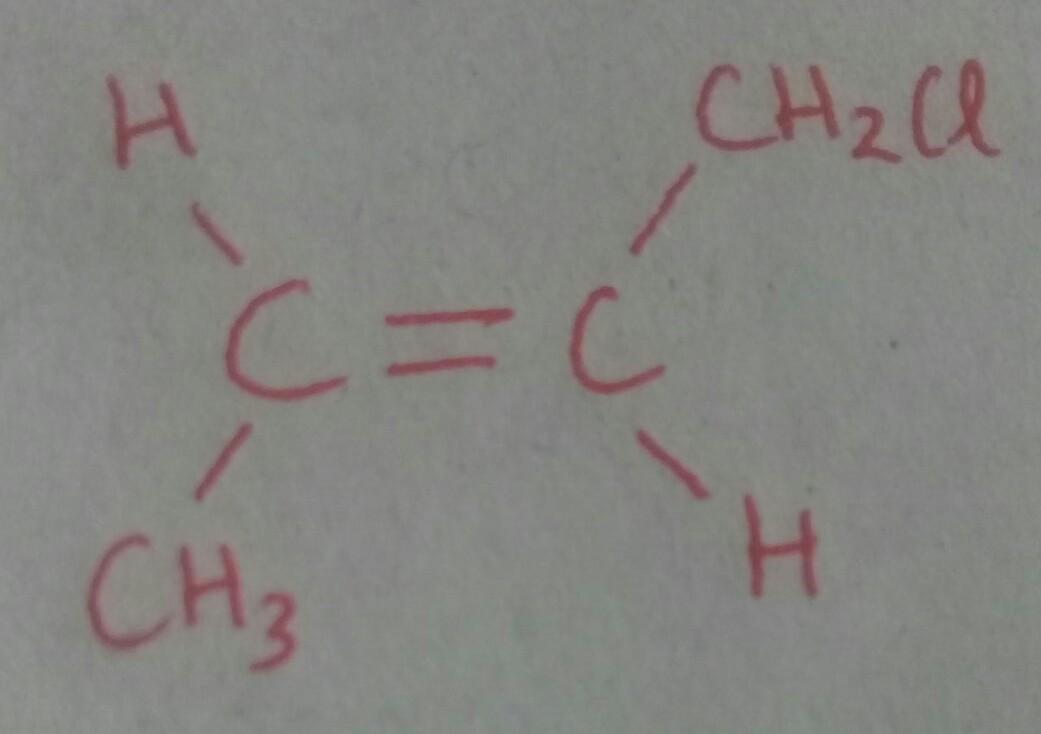
Kimia, Sekolah Menengah Atas
Penjelasan:
Atom H pada C yang berikatan rangkap berada pada posisi berseberangan.
Berdasarkan definisinya bentuk molekul dipengaruhi oleh …,
Kimia, Sekolah Menengah Pertama
Jawaban:
Berdasarkan teori VSEPR, bentuk molekul dipengaruhi oleh tolakan antar pasangan elektron valensi baik yang berupa pasangan elektron ikatan (PEI) maupun pasangan elektron bebas (PEB).
Elektron-elektron akan menempatkan posisi sedemikian rupa agar tolakan antara elektron-elektron tersebut menjadi sekecil mungkin. Jika kita urut kekuatan tolakannya, maka lebih kurang seperti ini :
Tolakan PEB dengan PEB > PEB dengan PEI > PEI dengan PEI.
Gaya tolak-tolak ini juga mempengaruhi besarnya sudut ikatan dalam suatu molekul.
Sehingga, bentuk molekul dipengaruhi oleh susunan ruang pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) pada atom pusat suatu molekul. Teori ini juga dikenal dengan teori VSEPR (Valence Shell Electron Pair Repulsion).
# semoga membantu
Tulislah contoh tiga benda yang menggunakan bahan zat tiunggal .
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m
m tolong ppppppppppppppppppppppppp
コインをもらってください
Kimia, Sekolah Menengah Atas
Jawaban:
Zat tunggal bisa ditemui dengan mudah di sekitar kita. Contohnya air, garam, gula, kayu, oksigen, besi, emas 24 karat, dan lain sebagainya.
Contoh tiga benda yang menggunakan bahan zat tunggal adalah Air, Kawat Besi, Kawat Tembaga.
✧ ☛ Pembahasan ☚ ✧
➩ Pengertian
- Zat tunggal adalah suatu zat yang mempunyai satu unsur atau senyawa. Sebutan lain dari zat tunggal adalah zat murni. Zat tunggal dibutuhkan oleh manusia untuk reaktan dalam melakukan reaksi kimia.
➩ Ciri – ciri
- Tidak mempunyai perubahan titik didih
- Tidak mempunyai perubahan titik leleh
- Mempunyai sifat murni, terdiri dari suatu materi dan tidak tercampur oleh zat lain
- Mempunyai konstan ( Homogen )
- Hanya tersusun dari satu zat atau materi
➩ Contoh
- Air
- Gula
- Garam
- Gas Oksigen
- Gas Hidrogen
- Kawat Besi
- Kawat Tembaga
Sifat zat tunggal
- Tidak bisa diuraikan kembali menjadi zat yang lebih sederhana melalui reaksi kimia
- Terdiri dari satu jenis atom
✧ ☛ Kesimpulan ☚ ✧
Jadi, dapat disimpulkan bahwa contoh benda yang menggunakan bahan zat tunggal adalah Air, Kawat Besi, dan Kawat Tembaga.
———————————————————–
Pelajari lebih banyak lagi tentang zat tunggal yuk!
- Materi tentang zat tunggal :
- Wujud materi :
- Perubahan materi :
———————————————————–
Detail Jawaban
Kelas : 10 SMA
Mapel : Kimia
Materi : Bab 1 – Materi
Kode Kategorisasi : 10.7.1
#BelajarBersamaBrainly
Bila diketahui
Al3+ (aq) + 3e- → Al (s) E°red = -1,66 V
Fe2+ (aq) + 2e- → Fe (s) E°red = – 0,44 V
Na+ (aq) + e- → Na (s) E°red = – 2,71 V
Cu2+ (aq) + 2e- → Cu (s) E°red = 0,34 V
tentukan
a. Tentukan tegangan yang dihasilkan oleh sel galvanik dari elektroda
aluminum dalam larutan ion Al3+ dengan elektroda besi dalam larutan ion
Fe2+. Tunjukan elektroda yang bertindak sebagai anoda dan katoda? (E°
sel =
1,22 V)
b. Tentukan tegangan yang dihasilkan oleh sel galvanik dari elektroda sodium
dalam larutan ion Na+ dengan elektroda tembaga dalam larutan ion Cu2+.
Tunjukan elektroda yang bertindak sebagai anoda dan katoda? (E°
sel = 3,05 V)
Kimia, Sekolah Menengah Atas
Jawaban:
Sebagai catatan:
- Semakin kecil potensial reduksi, semakin cenderung mengalami oksidasi.
- Untuk sel volta atau galvani, katoda adalah kutub positif dan anoda kutub negatif.
- Pada katoda terjadi reduksi, sedangkan pada anoda terjadi reaksi oksidasi
a) Karena potensial reduksi Al lebih kecil dibandingka Fe, maka Al akan mengalami oksidasi menjadi Al3+ dan Fe2+ akan mengalami reduksi menjadi Fe. Sehingga logam Al bertindak sebagai anoda dan logam Fe sebagai katoda.
E sel = E katoda – E anoda
= -0,44 V – (-1,66)
= +1,22 V
b) Karena potensial reduksi Na lebih kecil dibanding Cu. Maka Na akan mengalami oksidasi menjadi Na+ dan Cu2+ akan mengalami reduksi menjadi Cu. Sehingga logam Na akan menjadi anoda dan Cu sebagai katoda. Saya menganggap larutannya bukan sistem pelarut air karena tidak mungkin logam natrium sebagai elektroda jika elektrolitnya dalam sistem larutan berair.
E sel = E katoda – E anoda
= +0,34 V – (-2,71 V)
= +3,05 V
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

