Sistem koloid yang partikelnya tidak menarik molekul pelarutnya disebut
Mapel Kimia, Jenjang Sekolah Menengah Pertama
Jawaban:
Liofob
Penjelasan:
Liofil adalah sistem koloid yang berinteraksi kuat dengan medium pendispersinya (suka menarik). Jika medium pendispersinya air maka disebut hidrofil.
Liofob adalah sistem koloid yang berinteraksi lemah dengan medium pendispersinya (tidak menarik). Jika medium pendispersinya air maka disebut hidrofob.
liofob ✔️
penjelasan ⤵️
Koloid liofob adalah sistem koloid yang fase terdispersinya tidak suka menarik medium pendispersinya.
# semoga membantu
Pertanyaan Baru di Kimia
Mohon bantuannya ya kak

Kimia, Sekolah Menengah Atas
Jawaban:
Sesuai Hukum Hess, perubahan entalpi tersebut dapat dihitung dengan cara yang ada pada foto.
Tuliskan rumus kimia senyawa untuk: a)raksa(II)klorida
b)titanium(IV)klorida
c)tembaga(II)sulfat
d)kobalt(II)klorida
e)timbal(II)asetat
f)timahl(IV)oksida
g)besi(III)sulfida
h)krom(III)oksida
i)mangan(II)sulfat
j)vanadium(V)oksida
Kimia, Sekolah Menengah Atas
Berikut adalah pasangan rumus kimia dan nama senyawa berikut:
- Raksa (II) klorida
HgCl₂ - Titanium (IV) klorida
TiCl₄ - Tembaga (II) sulfat
CuSO₄ - Kobalt (II) klorida
CoCl₂ - Timbal (II) asetat
Pb(CH₃COO)₂ - Timah (IV) oksida
SnO₂ - Besi (III) sulfida
Fe₂S₃ - Krom (III) oksida
Cr₂O₃ - Mangan (II) sulfat
MnSO₄ - Vanadium (V) oksida
V₂O₅
Pembahasan
Pada penulisan rumus kimia perlu diperhatikan bilangan oksidasi Ibiloks) dari masing-masing unsur penyusun senyawa/molekul. Jumlah unsur pada senyawa/molekul biasanya diwakilkan oleh biloks dari unsur pasangannya.
Bilangan oksidasi logam dapat diketahui dari nama senyawa pada bagian angka romawi untuk golongan transisi dan untuk logam golongan A sudah pasti dari nomor golongannya. Adapun rumus kimia anionnya dapat diperoleh dari tabel periodik unsur atau referensi tertentu (untuk ion poliatomik).
- Raksa (II) klorida
Raksa = Hg dengan biloks +2
klorida = Cl dengan biloks -1,
maka rumus kimianya:
HgCl₂ - Titanium (IV) klorida
Titanium = Ti dengan biloks +4
klorida = Cl dengan biloks -1,
maka rumus kimianya:
TiCl₄ - Tembaga (II) sulfat
Tembaga = Cu dengan biloks +2
sulfat = SO₄ dengan biloks -2
maka rumus kimianya:
CuSO₄ - Kobalt (II) klorida
Kobalt = Co dengan biloks +2
klorida = Cl dengan biloks -1,
maka rumus kimianya:
CoCl₂ - Timbal (II) asetat
Timbal = Pb dengan biloks +2
asetat = CH₃COO dengan biloks -1,
maka rumus kimianya:
Pb(CH₃COO)₂ - Timah (IV) oksida
Timah = Hg dengan biloks +4
oksida = O dengan biloks -2,
maka rumus kimianya:
SnO₂ - Besi (III) sulfida
Besi = Fe dengan biloks +3
sulfida = S dengan biloks -2,
maka rumus kimianya:
Fe₂S₃ - Krom (III) oksida
Krom = Cr dengan biloks +3
oksida = O dengan biloks -2,
maka rumus kimianya:
Cr₂O₃ - Mangan (II) sulfat
Mangan = Mn dengan biloks +2
sulfat = SO₄ dengan biloks -2
maka rumus kimianya:
MnSO₄ - Vanadium (V) oksida
Raksa = V dengan biloks +5
oksida = O dengan biloks -2,
maka rumus kimianya:
V₂O₅
Pelajari lebih lanjut
- Materi tentang penamaan senyawa:
- Materi tentang nama senyawa ionik:
- Materi tentang rumus senyawa:
______________
Detail jawaban
Mapel : Kimia
Kelas : 10
Bab : Tata Nama dan Persamaan Reaksi
Kode : 10.7.5
#SolusiBrainlyCommunity
100 ml larutan hcl 0 1 m dicampurkan dengan 400 ml larutan hcl 0,5 m dan ph larutan adalah
Kimia, Sekolah Menengah Atas
Apabila 100 mL larutan HCl 0.1 M dicampurkan dengan 400 mL larutan HCl 0.5 M, maka akan menghasilkan larutan HCl dengan nilai pH sebesar 2 – log (42). Nilai ini menunjukkan larutan bersifat asam.
Penjelasan dengan langkah-langkah
Nilai pH atau derajat keasaman menunjukkan besarnya ion hidrogen terlarut dalam larutan. Pada pencampuran dua larutan asam yang sama, maka untuk mengetahui konsentrasi larutan asam itu cukup dengan menjumlahkan molnya dan selanjutnya membaginya dengan volume total campuran sebagaimana konsep molaritas pada umumnya. Berikut persamaan perhitungan molaritas HCl dalam larutan :
Diketahui :
- [HCl] 1 = 0.1 M
V 1 = 100 mL = 0.1 L - [HCl] 2 = 0.5 M
V 2 = 400 mL = 0.4 L
Ditanya :
- nilai pH campuran = ?
Penyelesaian :
- Hitung nilai mol HCl 1
mol HCl 1 = [HCl] x V HCl
mol HCl 1 = 0.1 M x 0.1 L
mol HCl 1 = 0.01 mol - Hitung nilai mol HCl 2
mol HCl 2 = [HCl] x V HCl
mol HCl 2 = 0.5 M x 0.4 L
mol HCl 2 = 0.2 mol - Hitung total mol HCl campuran
mol HCl total = mol HCl 1 + mol HCl 2
mol HCl total = 0.01 + 0.2
mol HCl total = 0.21 mol - Hitung [HCl] campuran
[HCl] campuran = mol HCl total : V total
[HCl] campuran = 0.21 mol : (0.1+0.4) L
[HCl] campuran = 0.21 : 0.5 L
[HCl] campuran = 0.42 M - Hitung [H⁺]HCl → H⁺ + Cl⁻
[H⁺] = [HCl] = 0.42 M - Hitung pH campuran
pH = – log ([H⁺])
pH = – log (0.42)
pH = 2 – log (42)
Kesimpulan
Jadi pH campuran adalah 2 – log (42).
Pelajari lebih lanjut
- Materi tentang konsep mol:
- Materi tentang pH campuran :
- Materi tentang perhitungan nilai pH:
______________
Detail jawaban
Mapel : Kimia
Kelas : 11
Bab : Stoikiometri larutan
Kode : 11.7.6
#SolusiBrainlyCommunity
Pasangan senyawa berikut yang dalam larutannya menghasilkan ion OH- adalah…. A. HNO3 dan CH3COOH
B. Ca(OH)2 dan Mg(OH)2
C. CH3COOH dan Mg(OH)2
D. Ca(OH)2 dan CHOOH
E. CH3COOH dan NaOH
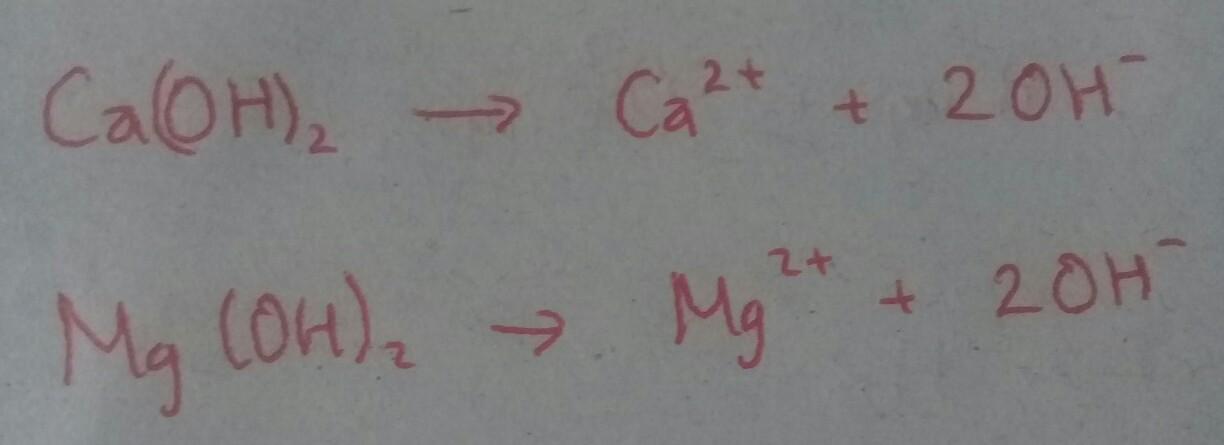
Kimia, Sekolah Menengah Atas
Jawaban:
B. Ca(OH)2 dan Mg(OH)2
Penjelasan:
Cek di foto ya
100 ml larutan ba(oh)2 memiliki ph 12. jika larutan ba(oh)2 ditambahkan 1900 ml air, maka konsentrasi ba(oh)2 setelah ditambah air adalah
Kimia, Sekolah Menengah Atas
Jawaban:
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

