100 gram C3H8 direaksikan sempurna dengan 100 gram O2, hitung jumlah massa gas-gas hasil reaksi. Bila Ar C=12, H=1, O= 16 (gram/mol)
Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
massa CO2 : 83,16 gram
massa H2O : 45,36 gram
Penjelasan:
pembakaran hidrokarbon selalu menghasilkan CO2 dan H2O
C3H8 + O2 —–> CO2 + H2O
setarakan reaksinya sehingga menjadi
C3H8 + 5O2 —-> 3CO2 + 4H2O
hitung mol mula-mula masing2 pereaksi
mol : massa/Mr
mol C3H8 : 100/44 = 2,27 mol
mol O2 : 100/32 = 3,13 mol
C3H8 + 5O2 ——> 3CO2 + 4H2O
m 2,27. 3,13
b. 0,63 3,13. 1,89. 2,52
s. 1,64. -. 1,89. 2,52
sehingga mol CO2 dan H2O yang dihasilkan berturut2 adalah 1,89 dan 2,52 mol
massa CO2:
massa = mol . Mr
= 1,89 . 44
= 83,16 gram
massa H2O
massa = mol . Mr
= 2,52 . 18
= 45,36 gram
kalo benar kasih jawaban terbaik, kalo salah komen:)
Pertanyaan Baru di Kimia
5. Berikut ini berturut – turut rumus kimia dari garam, cuka, amonia, dan air adalah …… a. NaOH, NaCl, NH3, dan H2O c. NaCl, CH3COOH, NH3, H2O
b. NaCl, NaOH, CH3COOH, H2O d. NaCl, CH3COOH NH3, H2O
Kimia, Sekolah Menengah Atas
Berikut ini berturut – turut rumus kimia dari garam, cuka, amonia, dan air adalah NaCl, CH₃COOH, NH₃ dan H₂O. enamaan senyawa diatur oleh IUPAC (International Union Pure and Applied Chemistry) berdasarkan kesepakatan oleh para ahli ilmuan didunia.
Penjelasan dengan langkah-langkah
Tata Nama Senyawa
Untuk mengetahui nama suatu senyawa terlebih dahulu kita harus memahami tentang lambang unsur dan nama unsur kimia. Hal tersebut merupakan ilmu dasar yang harus diketahui untuk memperdalam tentang tata nama senyawa. Penamaan senyawa diatur oleh IUPAC (International Union Pure and Applied Chemistry) berdasarkan kesepakatan oleh para ahli ilmuan didunia.
Langkah pertama yang akan kita lakukan adalah menentukan apa saja yang diketahui dari soal:
- Garam
- Cuka
- Amonia
- Air
Sedangkan langkah yang kedua adalah kita menentukan yang ditanyakan dari soal adalah
Rumus kimia
Jawab:
- Menentukan rumus kimia garam.
Garam adalah nama kimia dari natrium klorida yaitu NaCl. NaCl terdiri dari 2 atom yaitu atom Na dan atom Cl.
- Menentukan rumus kimia cuka.
Cuka adalah nama kimia dari asam cuka atau asam asetat yaitu CH₃COOH. CH₃COOH terdiri dari 3 atom yaitu atom C, atom H dan atom O.
- Menentukan rumus kimia amonia.
Amonia adalah nama kimia dari NH₃. NH₃ terdiri dari 2 atom yaitu atom H dan atom N.
- Menentukan rumus kimia air.
Air adalah nama kimia dari H₂O. H₂O terdiri dari 2 atom yaitu atom H dan atom O.
Berdasarkan perhitungan diatas, kesimpulan yang kita dapatkan adalah
Garam = NaCl
Cuka = CH₃COOH
Amonia = NH₃
Air = H₂O
Pelajari lebih lanjut
- Materi tentang Tata nama senyawa biner logam
- Materi tentang Tata nama senyawa poliatom
- Materi tentang Tata nama senyawa biner non logam
Detil Jawaban
Mapel : Kimia
Bab : Tata Nama Senyawa dan Persamaan Reaksi
Kelas : X
Semester : 2
Kode : 10.7.7
#AyoBelajar
#SPJ2
100 gram C3H8 direaksikan sempurna dengan 100 gram O2, hitung jumlah massa gas-gas hasil reaksi. Bila Ar C=12, H=1, O= 16 (gram/mol)
Kimia, Sekolah Menengah Atas
Jawaban:
massa CO2 : 83,16 gram
massa H2O : 45,36 gram
Penjelasan:
pembakaran hidrokarbon selalu menghasilkan CO2 dan H2O
C3H8 + O2 —–> CO2 + H2O
setarakan reaksinya sehingga menjadi
C3H8 + 5O2 —-> 3CO2 + 4H2O
hitung mol mula-mula masing2 pereaksi
mol : massa/Mr
mol C3H8 : 100/44 = 2,27 mol
mol O2 : 100/32 = 3,13 mol
C3H8 + 5O2 ——> 3CO2 + 4H2O
m 2,27. 3,13
b. 0,63 3,13. 1,89. 2,52
s. 1,64. -. 1,89. 2,52
sehingga mol CO2 dan H2O yang dihasilkan berturut2 adalah 1,89 dan 2,52 mol
massa CO2:
massa = mol . Mr
= 1,89 . 44
= 83,16 gram
massa H2O
massa = mol . Mr
= 2,52 . 18
= 45,36 gram
kalo benar kasih jawaban terbaik, kalo salah komen:)
Kelompokkan struktur senyawa karbon berikut ke dalam senyawa karbon jenuh atau senyawa karbon tidak jenuh.
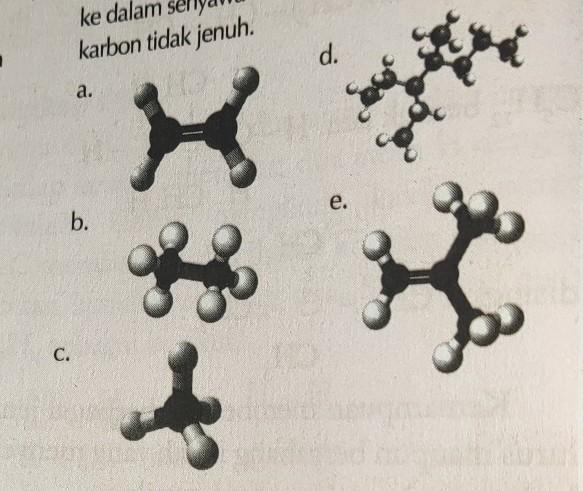
Kimia, Sekolah Menengah Atas
Penjelasan:
penentuan senyawa karbon jenuh dan tak jenuh ditentukan berdasarkan ikatan yang ada di dalam strukturnya. apabila hanya memiliki ikatan tunggal (alkana) maka disebut senyawa karbon jenuh. sedangkan apabila memiliki ikatan rangkap (alkena dan alkuna) maka disebut senyawa karbon tak jenuh.
pada gambar, senyawa a dan e memiliki ikatan rangkap sehingga disebut senyawa karbon tak jenuh
sedangkan b,c, dan d hanya memiliki ikatan tunggal maka disebut senyawa karbon jenuh
pada label sebuah botol yang berisi larutan natrium hidroksida (NaOH)tertera molaritas larutan tersebut adalah 0,02m, maka pH larutan tersebut….
Kimia, Sekolah Menengah Atas
Penjelasan:
NaOH termasuk ke dalam larutan basa kuat, maka rumus yang digunakan adalah
[OH-]=M×valensi basa [OH-]=2×10^-2pOH= 2-log2
pH=14-(2-log2)
pH= 12+log2
Perbandingan massa besi dan massa oksigen pada senyawa besi (II) oksida adalah 7 : 2. Jika gas oksigen yang diperlukan adalah 14 gram. Maka massa besi yang bereaksi adalah …. Pilih salah satu:
a. 14 gram
b. 49 gram
c. 2 gram
d. 7 gram
e. 42 gram
Kimia, Sekolah Menengah Atas
Jawaban:
E.
Penjelasan:
Dengan perbandingan masaa Fe : O = 7 : 2 dan massa Oksigen yg diketahui adalah 14 gram, maka massa besi yg bereaksi = ( 7 / 2 ) x 14 gram = 49 gram
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

